「臓器を個別に制御する自律神経の仕組み」-No.476
- nextmizai
- 2024年12月14日
- 読了時間: 15分
臓器を個別に制御する自律神経の仕組みを解明
-交感神経の理解をメジャーアップデートへ-
理化学研究所(理研)生命機能科学研究センター 比較コネクトミクス研究チームの播磨 有希子 基礎科学特別研究員(研究当時)、宮道 和成 チームリーダーらの共同研究グループは、マウスを用いて、副腎と腸管の機能をそれぞれ制御する交感神経[1]の異なるサブタイプ[1]が脊髄の中に存在することを発見しました。
本研究成果は、交感神経による全身の臓器機能の制御に関して、臓器やその機能ごとに専用のサブタイプが用意されているという新しい概念を提案し、将来的に臓器機能の不調を原因とする疾患の治療戦略に貢献すると期待できます。
ヒトを含む動物のさまざまな臓器は、交感神経と副交感神経[1]から拮抗的な制御を受けています。これらの自律神経[1]は、全身の臓器を一斉に一方向に制御するものと捉えられており、個々の臓器に特化した精細な制御があるとはこれまで一般に認識されてきませんでした。
共同研究グループは、マウスをモデルとして、消化管の蠕動運動をつかさどる腹腔神経節[2]やアドレナリンの分泌を担う副腎髄質[3]を制御する交感神経がどのような細胞種で構成されているのかを、組織学的な観察、網羅的な遺伝子発現パターン解析、ウイルスベクターを用いた遺伝学的な操作法を用いて調べました。その結果、これらの交感神経は共に脊髄の下部胸髄[4]に存在するものの、遺伝子発現パターンによって明瞭に区別することのできるサブタイプに分けられ、そのうちの一群は消化管の蠕動運動を低下させる機能を、別の一群は副腎髄質を介して血糖値を上昇させる機能を、それぞれ持っていることが分かりました。
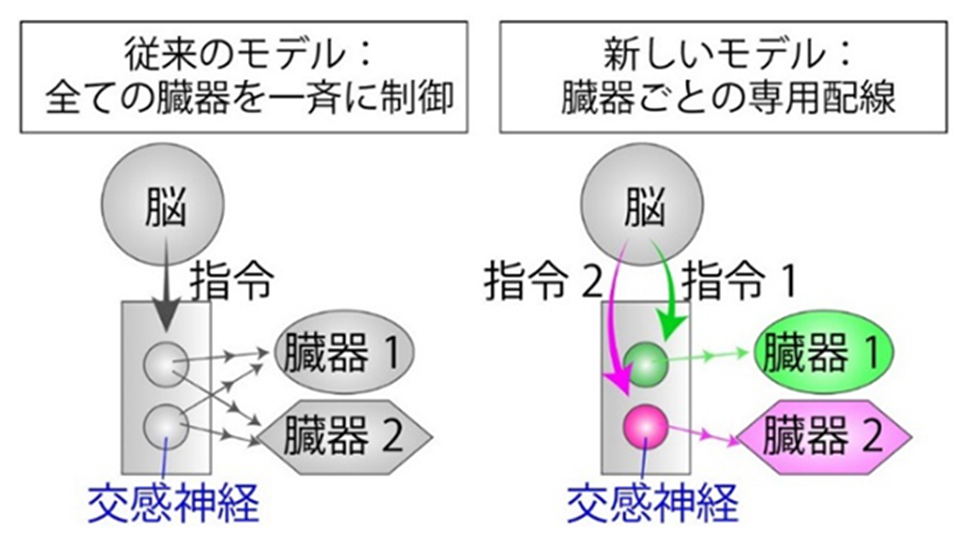
交感神経による臓器制御の新しいモデル:臓器ごとに専用の配線を持つ神経回路を発見
背景
自律神経系は循環系、呼吸系、消化器系、生殖器系などさまざまな臓器を無意識に制御し、これらの機能を最適な状態に調節することで、外界の変化に適応し、生命を維持する重要な機能を担っています。例えば、天敵に襲われた動物は、瞳孔が開き、全身の毛が逆立ち、心臓は激しく脈打ち、呼吸は浅く速くなるといった闘争・逃走反応[5]と呼ばれる反応を示し、危機に対応します。米国の著名な生理学者ウォルター・キャノン[6]は著書の中で、闘争・逃走反応とは交感神経を介して全身にエネルギーを供給する仕組みだと解説し、以下のように述べています。
「"交感神経系は、体内環境の深刻な変化を防ぐために、迅速かつ直接的に作用し、身体のエネルギーを動員する役割を果たす。各種の交感神経の出力は一方向に同時に作用し、さまざまな臓器に及ぶように組織されている。」- Wisdom of the Body (1939)"
このようにキャノンは、交感神経の出力を1種類の全身性の指令として理解していました。この考え方は現在でも大きく修正されず受容されています。
一方で、交感神経の出力は個別の臓器あるいは臓器群ごとに、もっと細分化されているのではないかという考えも存在しました。例えば、神経細胞同士の情報伝達に関与するさまざまな神経ペプチド[7]や受容体遺伝子が交感神経に一様に発現するわけではなく、何らかのパターンがあることが見つかってきました。しかし、交感神経はどのように分類されるべきか、その分類がどのように臓器の制御と関連しているのか、という根本的な問題は未解決のままで現在に至っています。
共同研究グループは、交感神経の個別性と臓器制御の関連を解明するためには、遺伝学ツールの発達したマウスをモデルとする必要があると考えました。そこで、近年発表された遺伝子発現を網羅的に調べることのできる1細胞RNA sequence法[8]による交感神経の分類を活用するとともに、ウイルスベクターを用いた神経細胞の標識技術を交感神経の研究に導入することにしました。
研究手法と成果
共同研究グループはまず、腸管の蠕動運動を制御する交感神経である腹腔・上腸間膜神経節(以下、腹腔神経節)に軸索の末端から細胞体へと逆行的に感染するウイルスベクターを導入することで、この神経節を制御している交感神経を特異的に標識する方法を確立しました。標識された細胞は、脊髄の主に第8~13胸髄(下部胸髄)に存在しました。組織化学的な手法を用いて、1細胞RNA sequence法による交感神経の分類結果と照合してみると、この神経節に軸索を伸ばす交感神経は、神経ペプチドを作るCartpt[9]という遺伝子マーカーを発現する特定のサブタイプに属することが分かりました。
次に、ウイルスベクターを用いてCartptを発現する下部胸髄の交感神経を特異的に標識することができる実験系を確立しました(図1A)。軸索を標識して観察すると、Cartpt陽性の交感神経は予想通り腹腔神経節に軸索を接続しましたが、意外なことに、腹腔神経節のすぐ近くに存在する副腎髄質には全く軸索を送りませんでした(図1B右)。この結果を受けて、共同研究グループが副腎髄質に軸索を伸ばす交感神経を探索したところ、神経ホルモン・オキシトシンの受容体を作るOxtr[9]遺伝子をマーカーとして発現する交感神経の一群が発見されました。Oxtr陽性の交感神経を標識すると、その軸索は副腎髄質に存在し、腹腔神経節に全く存在しませんでした(図1B左)。CartptあるいはOxtrを発現する交感神経は共に下部胸髄に存在しますが、全く重なり合わない相異なる集団です。このように、下部胸髄の交感神経は、遺伝子発現により細分化が可能で、それぞれのサブタイプが互いに異なる軸索の接続先を持つことが分かりました。
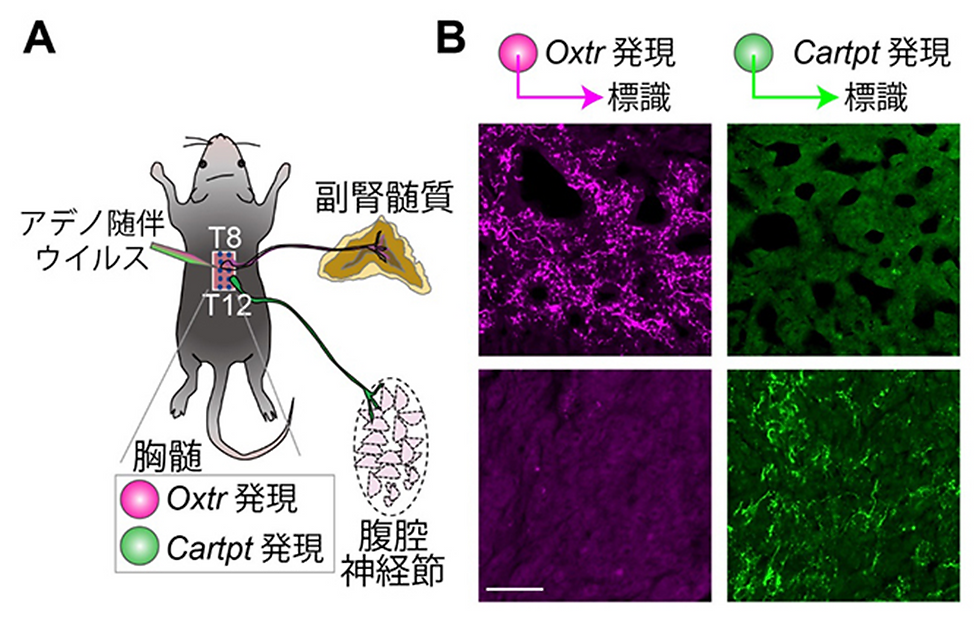
図1 下部胸髄に存在する2種類の交感神経の特異的な軸索投射
A.下部胸髄に存在する2種類の交感神経を特異的に標識する実験の模式図。T8は第8胸髄、
T12は第12胸髄を示す。実験では、OxtrあるいはCartptを発現する交感神経において
特異的に標識蛍光タンパク質を発現するように細工したアデノ随伴ウイルスをT8~T12の
領域に注入し、標識された軸索を観察した。
B.代表的な蛍光顕微鏡観察像。上が副腎髄質、下が腹腔神経節の切片。左側2枚はOxtrを
発現する交感神経の軸索、右側2枚はCartptを発現する交感神経の軸索をそれぞれ示す。
色は疑似カラー。Oxtrを発現する交感神経は副腎髄質に、Cartptを発現する交感神経は
腹腔神経節に、それぞれ特異的に投射した。スケールバーは100マイクロメートル
(μm、1μmは1,000分の1ミリメートル)。
副腎髄質と腹腔神経節とが相異なる交感神経のサブタイプに支配されているという知見から、この両者を別々に制御することが可能だと考えられます。そこで共同研究グループは、OxtrあるいはCartptを発現する交感神経のいずれか一方だけを、薬理遺伝学[10]と呼ばれる手法で任意の時期に活性化できるようにしました。まず、腹腔神経節の支配を受ける腸管の機能に着目しました。闘争・逃走反応では危機に対処するエネルギーを確保するため、緊急性の高くない消化機能は抑制されることが知られています。マウスに色素を食べさせてから着色便が排せつされるまでの時間を腸管通過時間と呼び、この時間が長いほど、腸通過に時間がかかることを示し、腸のぜん動運動が低下していることの指標となります。Oxtrを発現する交感神経を活性化させる前後で腸管通過時間に有意な違いはありませんでしたが、Cartptを発現する交感神経を活性化させると、雌雄どちらのマウスも腸管通過時間が有意に延伸しました(図2A)。この結果は、腹腔神経節を支配するCartpt陽性の交感神経が、実際に消化管の蠕動運動を抑制する機能を有することを示しています。
闘争・逃走反応では危機に対応するエネルギー源として血糖値が上昇しますが、副腎髄質はこの血糖値の上昇に寄与すると考えられています。そこで、交感神経のサブタイプを活性化させて血糖値を測定しました。Cartptを発現する交感神経を活性化させても血糖値は変化しませんでしたが、Oxtrを発現する交感神経を活性化させると雄マウスだけ顕著な血糖値の上昇を示しました(図2B)。一方、雌マウスでは血糖値は変化しませんでした。この雌雄差の生じる仕組みははっきりしていませんが、先行研究では雄ラットの方がストレスによるアドレナリンの分泌量が多いことや、雌マウスの方がインスリンに対する感受性が高いことが知られています。これらのデータから、副腎髄質を支配するOxtr陽性の交感神経が血糖値の調整に関わるのに対して、腹腔神経節を支配するCartpt陽性の交感神経がこのプロセスに関与しない、という結論が得られました。
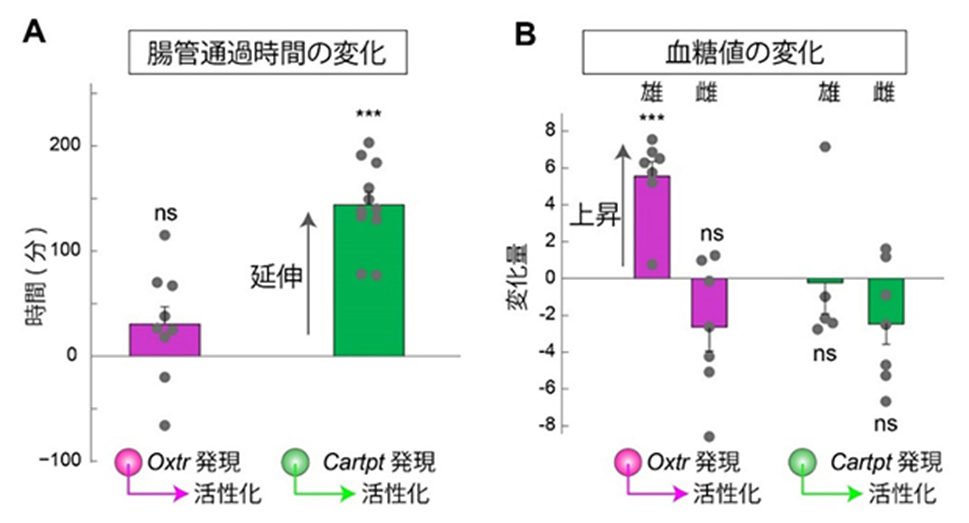
図2 交感神経サブタイプの特異的な活性化実験
A.マウスの腸管通過時間を測定した。同一個体で、交感神経を活性化させる前後で2回測定
し、その差を表示した。Oxtrを発現する交感神経を活性化しても腸管通過時間に変化は
ないが、Cartptを発現する交感神経を活性化すると平均120分以上の延伸が見られた。
B.交感神経を活性化させない条件と活性化させる条件でそれぞれ140分間の血糖値増加(血
糖値の時間変化を示す曲線を積分して求めた、血糖値×時間に相当する面積)を測定し、
その差分を変化量(単位はg・min/dL)として定量した。Oxtrを発現する交感神経を活性化
させると、雄マウスにおいて有意な血糖値の上昇を認めたが雌マウスでは変化がなかっ
た。また、Cartptを発現する交感神経の活性化は血糖値に影響しなかった。
ns(non-significant)は有意差がないこと示し、***は有意水準0.001において有意な違い
があることを示す。
共同研究グループは最後に、副腎髄質を支配するOxtr陽性交感神経と腸管機能を制御するCartpt陽性交感神経が実際に使い分けられるような状況があるのかを検討しました。血糖値が急速に低下する状況は個体にとって深刻な危機で、交感神経は速やかに副腎髄質を活性化させて血糖値を回復させなくてはいけませんが、その際に腸管の機能を低下させる必要性はなさそうです。むしろ、腸管機能を維持して消化・吸収を進めたほうが、長期的には血糖値の低下に抵抗できるかもしれません。そこで、マウスに薬剤を注入して人為的に糖質の欠乏状態を誘導しました。その結果、下部胸髄において、Oxtrを発現する交感神経には神経活動のマーカーであるc-Fos遺伝子の発現が誘導され、副腎髄質の活性化が起きていることが分かりました。これに対して、Cartptを発現する交感神経はほとんどc-Fos遺伝子を発現せず、活性化されていないことが分かりました(図3A)。この結果は、糖質欠乏という危機に際して、副腎髄質を活性化しても交感神経が腸管機能を抑制しないことを示唆し、交感神経の出力はキャノンが考えたような1種類の全身性の指令ではなく、臓器レベルに細分化されている可能性を示しています。そして、遺伝子発現によって個性を付けられた交感神経のサブタイプが、脳からの指令を特定の臓器に伝達する"専門家"として機能していると考えられます(図3B)。
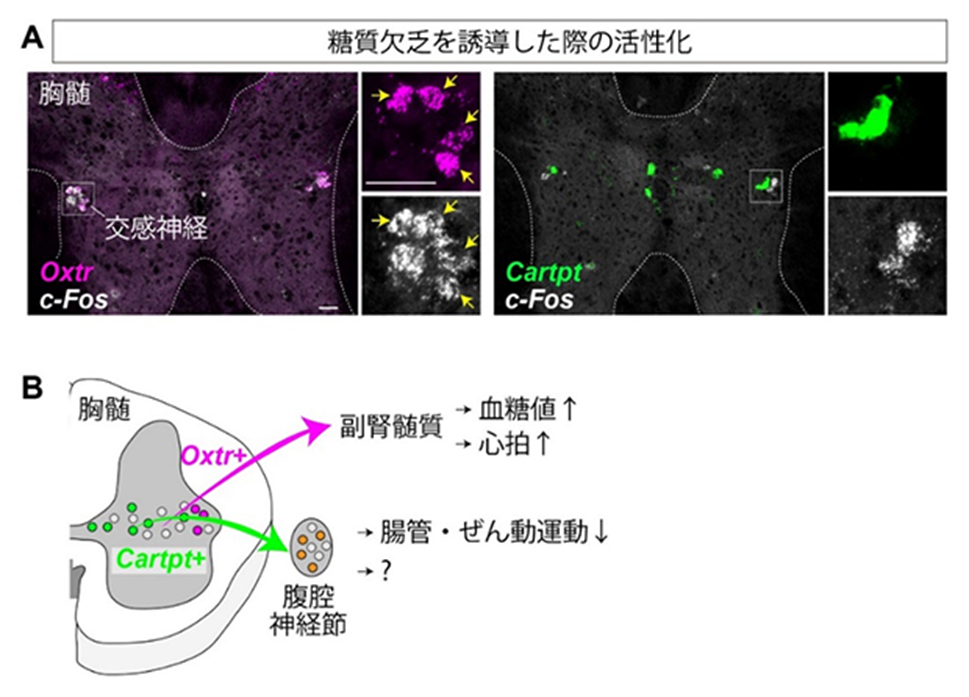
図3 糖質欠乏に対する交感神経の応答と全体のまとめ
A.薬剤を注入して人為的に糖質欠乏を誘導したマウスの下部胸髄における組織化学的解析。
高感度の検出法であるRNAscopeでOxtr、Cartpt、c-Fosの遺伝子発現を可視化した。
色は疑似カラー。□で囲われた部分は交感神経が多数存在する側角という領域。色チャネ
ルを分離した拡大図を右側に示した。黄色の矢印は共発現細胞を示す。Oxtr陽性細胞の8
割にc-Fos遺伝子が発現した(矢印)のに対し、Cartpt陽性細胞はほとんどc-Fosを発現し
なかった。スケールバーは50μm。
B.本研究のまとめ。下部胸髄にはOxtrあるいはCartptを発現する交感神経のサブタイプが
存在し、それぞれ副腎髄質、腹腔神経節に特異的に投射する。前者は、血糖値や心拍数の
増加に寄与し、後者は腸管におけるぜん動運動の抑制に関与する。なお心拍数の増加は、
副腎髄質から放出されるホルモンによる間接的な影響と考えられる。またCartpt陽性の
交感神経が腹腔神経節を介して腸管以外の臓器を制御する可能性も残されており、今後の
検討が必要である。
今後の期待
本研究により、脊髄の交感神経を対象に、1細胞RNA sequenceデータを用いた神経細胞の分類やウイルスベクターによる精密な標識・神経活動の操作系が確立されました。その結果、一方向に同時に作用すると考えられてきた交感神経に、分子レベルで規定される臓器ごとの専用配線の存在が見えてきました(図3B)。ただし、Cartptを発現する交感神経の支配する腹腔神経節は、腸管以外にも肝臓、脾臓、膵臓などさまざまな臓器を制御しているといわれており、Cartpt陽性の交感神経がこれらをまとめて統括しているのか、さらなるサブタイプに分割されるのか、今後も研究が必要です。
基礎科学的には、交感神経による臓器ごとの専用配線があるという今回の発見が、眼や心臓も含めた全ての臓器・臓器群に対して一般に成り立つのか、それとも下部胸髄の担当する副腎髄質や腹腔神経節でのみ成立するのか、研究を進める必要があります。臓器ごとの専用配線がより一般的に成り立つのであれば、交感神経の出力を一種類の全身性の指令として理解してきたキャノン以来の神経生理学をメジャーアップデートする必要が出てくるでしょう。その際、糖質欠乏に対する応答性がOxtrあるいはCartpt陽性の交感神経の間で大きく異なること(図3A)は注目に値します。今後、さまざまなストレス条件においてどのような交感神経のサブタイプが活動するのかを網羅するような活動地図を作ることも必要だと思います。
将来的には、さまざまな交感神経のサブタイプを特異的に操作することで、他の全身臓器に影響を与えずに特定の臓器機能だけを操作する技術が可能になるかもしれません。例えば、個別に脂肪を燃焼させたり代謝を高めたりといったことができれば、メタボリックシンドロームへの対策として有用性があります。
本研究で用いたサブタイプ特異的な交感神経の活性化手法は、遺伝子組換えを伴う薬理遺伝学の手法を用いているため直ちにヒトへと応用することはできません。しかし、交感神経サブタイプの機能やその遺伝子発現プロファイルの理解は、ヒトの臓器機能の不調を原因とする疾患の治療戦略に貢献するものです。
補足説明
交感神経、サブタイプ、副交感神経、自律神経
自律神経は、心拍数や血糖値、消化機能の制御など意識的な努力を必要とせず、自動的(自律的)に機能する神経系。交感神経と副交感神経から成り、全身の恒常性の維持に重要な役割を果たす。このうち、交感神経はストレスの多い状況や緊急事態に際して体の状態を整える役割があり、心拍数の上昇、気道の拡張、発汗、瞳孔の拡大、立毛などを促進し、消化や排尿を抑制する。副交感神経はエネルギーを温存し、体を休ませる役割があり、心拍数の減少、血圧の低下、消化管機能や排せつの促進を担う。本稿では、交感神経の一部を「サブタイプ」と呼んでおり、それぞれのサブタイプは遺伝子の発現や脊髄内の位置によって区別することができる。
神経節
末梢神経系における神経細胞が集まった構造。交感神経系は脊髄に存在する節前神経が、脊髄に並走する交感神経節あるいは臓器の近くに存在する内腔神経節において節後神経に乗り換えて臓器に到達する2段階の構造を取る。本稿では脊髄に存在する節前神経のことを「交感神経」と呼んでいる。腸管を制御する節後神経は腹腔神経節と上腸間膜神経節に分布するが、マウスにおいてはこの両者は区別が難しいため、本稿ではまとめて「腹腔神経節」と呼んでいる。
副腎髄質
副腎とは、腎臓の近くに存在する内分泌器官でさまざまなステロイドホルモンを分泌する副腎皮質とアドレナリンやノルアドレナリンを分泌する副腎髄質から成る。副腎髄質は、発生学的には交感神経の節後神経とよく似た性質を持っており、そのため、脊髄に存在する節前神経から直接神経支配を受ける。副腎髄質から分泌されたアドレナリンは、血流に乗って全身の代謝を高め、血糖値を増加させ、心拍数の上昇にも関与する。アドレナリンの精製は1901年に高峰譲吉と上中啓三によってなされた。
下部胸髄
脊髄の神経は対応する体の部位と緩やかな位置対応を有する。例えば、瞳孔の散大や気管の拡張など頭頸部に関連する交感神経は頸部に存在し頸神経と呼ばれるのに対し、心臓や肩甲骨褐色脂肪などを制御する交感神経は上胸部に存在する。本研究が取り扱う副腎髄質や腹腔神経節を支配する交感神経は第8~第12胸髄に存在し、これらを下部胸髄と呼んでいる。
闘争・逃走反応
Fight-or-flight response(戦うか逃げるかの反応)は、動物が危機的状況に対して示す反応で、米国の生理学者ウォルター・キャノン([6]参照)により定式化されて広められた。広範な交感神経の活性化により、心拍、血圧、呼吸数の上昇、血糖値、代謝の増加が起こり、逆に消化、免疫、性機能が抑制される。
ウォルター・キャノン
Walter Bradford Cannon(1871-1945)。米国の生理学者。自律神経研究のパイオニアであり、生体が平衡状態を保とうとする機能を「ホメオスタシス」と名付けた。
神経ペプチド
脳のニューロンで発現するペプチド。オキシトシン、エンドルフィンなど数十種類が存在し、ニューロンから分泌され、受容体に結合することで機能する。摂食、睡眠、繁殖、行動などを調整することが知られている。
1細胞RNA sequence法
DNAシーケンサーを用いて、1細胞中に含まれるRNAの量や種類を網羅的に決定する手法。細胞ごとの遺伝子発現プロファイルを基に細胞集団を分類し、各集団に含まれる細胞タイプ、割合、特徴的な遺伝子発現を同定できる。疾患に伴う遺伝子発現状態の変化を細胞タイプごとに観察できるため、バルクの解析では埋もれていた遺伝子発現状態の変化や細胞ごとの変化を検出できる。1細胞の単離が難しい神経細胞では、細胞の代わりに単離した核を用いるのが一般的で、本研究でも核を用いた解析を実施している。
Cartpt、Oxtr
本研究ではCartptあるいはOxtrは交感神経のサブタイプを標識するための目印(マーカー)として登場するが、これらの遺伝子には機能的な重要性も想定できる。Cartptはコカインおよびアンフェタミン調節転写物(CART)と呼ばれる神経ペプチドをコードする遺伝子である。視床下部において摂食を抑制する機能がよく知られているが、交感神経における機能は明らかになっていない。Oxtrはオキシトシン受容体をコードする遺伝子。オキシトシンは視床下部で産生される神経ホルモンで、母性機能や社会性行動を亢進(こうしん)させる作用が有名だが、代謝を高め、肥満を抑制する効果も知られている。交感神経におけるOxtrの機能についても今後の研究が必要である。
薬理遺伝学
神経科学のツールとしての薬理遺伝学とは、ある薬剤に特異的に応答して神経活動を操作できる人工的な受容体を用いて、特定の神経細胞集団の活動を操作する技術を指す。本研究では、ヒトのアセチルコリン受容体を改変して薬剤CNOにより人為的に活性化され、神経活動を亢進させるhM3Dq受容体が用いられた。






コメント